
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Бесінші аналитикалық топ катиондары
Бесінші аналитикалық топқа мына катиондар жатады: Fe3+, Fe2+, Mn2+, Bi3+, Mg2+, Sb3+, Sb 5+ .
Mn2+, Bi3+ және Mg2+ иондары - түссіз, Fe2+ ионы - ашық-жасыл, ал Fe3+ ионы - сары түсті.
Бесінші аналитикалық топ катиондарының нитраттары, сульфаттары және хлоридтері суда жақсы ериді. Бұл топ катиондарының гидроксидтері әлсіз, нашар еритін электролиттер. Төртінші және алтыншы аналитикалық топ катиондарының гидроксидтерінен айырмашылығы, олар аммиак ерітіндісі мен сілтінің артық мөлшерінде ерімейді.
Бесінші топтың топтық реагенті – NaOH-тың артық мөлшері.

Темір (II) катионының Fe2+ дербес реакциялары
I. Күйдіргіш сілтілермен темір (II) тұздары ашық-жасыл темір гидроксидін түзеді:
FeSO4 + 2KOH = Fe(OH)2↓ + K2SO4
Fe 2+ + 2OH- = Fe(OH)2↓
Тұнба ауада оттегі қатысында тез қоңырланып, темірдің (III) валентті гидроксидіне Fe(OH)3 дейін тотығады.
1-тәжірибе. Пробиркаға 2 тамшы темір (II) сульфаты ерітіндісін құйып, оған 2 тамшы сілті NaOH ерітіндісін қосыңдар. Тұнба түсінің өзгерісіне назар аударыңдар.
II. Калий гексацианоферраты (III) K3[Fe(CN)6] темір (II) катионымен «турнбулен көгі» деп аталатын темір гексацианоферратын (III)түзеді:
3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6] ↓ + 3K2SO4
3Fe2+ + 2[Fe(CN)6] 3- = Fe3[Fe(CN)6] ↓ 
Тұнба қышқылдарда ерімейді, бірақ сілтілерде ыдырайды. Бұл - темір (II) ионына Fe2+ тән ең сезімтал реакция.
2-тәжірибе. Пробиркаға 2-3 тамшы темір (II) сульфаты ерітіндісін құйып, оған 5 тамшы дистилденген су мен 2 тамшы калий гексацианоферратын (III)қосыңдар. Тұнбаның түсіне және сипатына назар аударыңдар.
Тәжірибені жүргізу шарттары:
1. Реакцияны рН = 3 болғанда жүргізу керек.
2. NaOH, KOH ерітінділерінің артық мөлшері тұнбаны «турнбулен көгін» ыдыратуға әкеліп соғады.
3. Fe3+ катионы және басқа да бесінші аналитикалық топ катиондары реакцияның жүруіне кері әсерін тигізбейді.
Темір (Ш) катионының Fe3+ дербес реакциялары
I. Күйдіргіш сілтілер KOH, NaOH және аммоний гидроксиді - NH4OH темір (Ш) катионымен Fe3+ қызыл-қоңыр тұнба темір гидроксидін Fe(OH)3 береді:
FeCI3 + 3KOH = Fe(OH)3↓ + 3KCl
Fe3+ + 3OH- = Fe(OH)3↓
Темір (Ш) гидроксиді қышқылдарда ериді, ал сілтілердің артық мөлшерінде ерімейді.
1-тәжірибе. 2 тамшы темір (Ш) хлориді ерітіндісіне 2 тамшы сілті NaOH ерітіндісін қосыңдар. Тұнбаның түсі мен сипатына көңіл аударыңдар.
Тәжірибені жүргізу шарттары:
1. Реакцияны жүргізу үшін рН>7 болуы керек;
2. Реакцияны аммоний тұзының қатысуымен жүргізуге болады.
II. Калий гексацианоферраты (II) 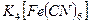 темір(Ш) катионымен Fe3+ қою-көк тұнба «берлин лазурін» береді. Реакцияны әлсізқышқылдық ерітіндіде жүргізген тиімді:
темір(Ш) катионымен Fe3+ қою-көк тұнба «берлин лазурін» береді. Реакцияны әлсізқышқылдық ерітіндіде жүргізген тиімді:
4FeCl3 + 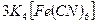 =
=  ↓ + 12KCl
↓ + 12KCl
4Fe3+ + 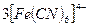 =
=  ↓
↓
Реакция өте сезімтал болғандықтан, бұл реакция зерттелетін ерітіндіден Fe3+ ионын анықтау үшін қолданылады.
2-тәжірибе. 2 тамшы темір (III) хлориді ерітіндісіне 1 тамшы 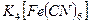 ерітіндісін тамызыңдар.
ерітіндісін тамызыңдар.
Тәжірибені жүргізу шарттары:
1. Реакцияны рН < 3 ортада жүргізеді.
2. Сілті ерітіндісінің артық мөлшері «берлин лазурі» тұнбасын ерітеді.
3. 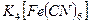 ерітіндісін артық мөлшерде алудың қажеті жоқ, себебі ол «берлин лазурі» тұнбасының ерігіштік формасын түзуге бейім болады.
ерітіндісін артық мөлшерде алудың қажеті жоқ, себебі ол «берлин лазурі» тұнбасының ерігіштік формасын түзуге бейім болады.
III. Калий роданиді KSCN темір (III) тұзының ерітіндісімен әлсізқышқылдық ортада қан-қызыл түсті темір роданидінің комплексті қосылысын түзеді:
FeCl3 + 3KSCN ↔ Fe(SCN)3 + 3KCl
Fe3+ + 3SCN- ↔ Fe(SCN)3
3-тәжірибе. Пробиркаға 2-3 тамшы темір (III) хлоридін құйып, оған 2 тамшы калий роданиді ерітіндісін қосыңдар. Ерітіндінің түсіне назар аударыңдар.
Тәжірибені жүргізу шарттары:
1. Реакция жүру үшін рН < 3 болуы керек.
2. Реакция толық жүру үшін концентрлі калий роданидін қолдану керек.
Марганец катионының Mn2+ дербес реакциялары
Марганец тұзыныңерітінділері ашық-қызғылт түсті, ал сұйытылған ерітінділері түссіз болады.
I. Күйдіргіш сілтілер KOH, NaOH марганец катионын ақ түсті марганец (II) гидроксиді түрінде тұнбаға түсіреді, түзілген тұнба қышқылдарда ериді, ал сілтілерде ерімейді:
MnSO4 + 2KOH = Mn(OH)2↓ + K2SO4
Mn2+ + 2OH- = Mn(OH)2↓
Тұнба ауада оттегімен марганецтің (IV) валентті тұздарына дейін тотығатындықтан қоңырланады.
1-тәжірибе. 2 тамшы марганец тұзы ерітіндісіне 2 тамшы сілті NaOH ерітіндісін тамызыңдар. Біраз тұрғаннан кейін тұнба түсінің өзгеретініне назар аударыңдар.
II. Mn2+ катионының калий периодатымен КIO4 тотығуы
Mn2+ катионы калий периодатымен КIO4 тотығып, MnO4– ионына тән түс пайда болады:
2MnCl2 + 5КIO4 + 3Н2О = 2HMnO4↓ + 5KIO3 +4HCl
2Mn2+ + 5IO4- + 3Н2О = 2HMnO4↓+5IO3- +4H+
2-тәжірибе. Бұл реакцияның жүруі үшін марганецтің жұғыны қажет. Пробирканы 2-3 тамшы марганец ерітіндісімен шайқайды да, шпательдің ұшымен ~ 0,1г КIO4 кристалдарын салады. Сосын 1-2 мл дистилденген су құйып, MnO4– ионына тән түстің пайда болғанын бақылайды.
III. Қорғасынның қос тотығына PbO2 концентрлі азот қышқылын қосып қыздырып, оған марганец (II) тұзын қоссақ, онда Mn2+ катионы MnO4- - ке дейін тотығып, ашық-қызғылт түсті марганецті қышқыл түзеді:
2Mn(NO3)2 + 5PbO2 + 6HNO3 = 2HMnO4 + 5Pb(NO3)2 + 2H2O
2Mn2+ + 5PbO2 + 4H+ = MnO4- + 5Pb2+ + 2H2O
3-тәжірибе. Пробиркаға шыны қалақшамен аз мөлшерде PbO2 салып, оған 5 тамшы концентрлі азот қышқылын қосып, қоспаны су жылытқышында қыздырады. Қыздырылған қоспаға 1 тамшы марганец (II) нитратын тамызып, пробирканы әлсін-әлсін сілкіп араластыра отырып, қайтадан 10-15 минут қыздырады. Қорғасынның қос тотығының артық мөлшерінің тұнғанын күтіп және түзілген марганецті қышқылдың ашық-қызғылт түсін бақылаңдар.
Тәжірибені жүргізу шарттары:
1. Реакция рН<2 болғанда жүргізіледі.
2. Марганец хлоридін алуға болмайды.
3.Тотықсыздандырғыш аниондар Мn2+ ионын MnO42- күйінде алуға кедергі жасайтындықтан, оларды алдын-ала бөліп тастау керек.
4. Аздап қыздыру реакцияның жүруіне оң әсерін тигізеді.
Висмут катионының Bi3+ дербес реакциялары
I. Гидролиз - висмутқа тән реакциялардың бірі.
1-тәжірибе. Висмут хлоридінің BiCl3 ерітіндісін алып, оны жақсылап дистилденген сумен сұйылтыңдар. Бұл кезде ақ түсті тұнба висмут хлоридінің негіздік тұзы Bi(OH)2Cl↓ түзіледі:
BiCl3 + 2H2O = Bi(OH)2Cl↓ + 2HCl
Түзілген негіздік тұз - тұрақсыз, ол су молекуласын бөліп, жаңа негіздік тұз- висмутил хлоридін BiOCl↓түзеді:
 Cl
Cl
 Bi ¾ OH = BiOCl↓ + H2O
Bi ¾ OH = BiOCl↓ + H2O 
OH
Тәжірибені жүргізу шарттары:
1. Гидролиз реакциясын висмут хлоридімен BiCl3 жүргізген дұрыс, себебі висмутил хлоридінің BiOCI ерігіштігі висмутил нитратына BiONO3 карағанда төмен.
2. Егер висмут нитраты Bi(NO3)3 қолданылған болса, онда ерітіндіге 2-3 тамшы аммоний NH4Cl хлоридін қосады.
3. Сурьманың тұздары реакцияның жүруіне кедергі жасайды.
4. Висмутил хлоридінің BiOCI стибил хлоридінен SbOCl айырмашылығы, оның шарап қышқылында ерімеуі.
II. Күйдіргіш сілтілер КОН, NaOH висмут катионыменBi3+ висмут гидроксидінің Bi(OH)3 ақ тұнбасын түзеді, ол тұнба сұйытылған қышқылдарда ерігенімен сілтілерде ерімейді:
BiCl3 + 3NaOH = Bi(OH)3↓ + 3NaCl
Bi3+ + 3OH- = Bi(OH)3↓
2-тәжірибе. Пробиркаға 3-4 тамшы висмут хлориді BiCl3 ерітіндісін және 2-3 тамшы сілті NaOH ерітіндісін құйыңдар. Ақ түсті тұнба түзіледі.
Магний катионының Mg2+ дербес реакциялары
І. KOH пен NaOH гидроксидтері магний катионымен Mg2+ ақ түсті аморфты магний гидроксидін Mg(OH)2 түзеді. Бұл тұнба қышқылдарда және аммоний хлоридінің тұзында да ериді.
1-тәжірибе. 2 тамшы магний тұзының ерітіндісіне 2 тамшы сілті NaOH ерітіндісін қосыңдар.
ІІ. Натрий гидрофосфаты Na2HPO 4 магний катионымен Mg2+ аммоний гидроксиді мен аммоний хлоридінің (аммиакты буферлі ерітінді: NH4OH+NH4Cl) қатысында ақ түсті кристалл тұнба магний-аммоний фосфатын MgNH4PO4 түзеді:
MgCl2 + Na2HPO4 + NH4OH = MgNH4PO4↓ + 2NaCl + H2O
Аммоний хлоридін NH4Cl қосатын себебіміз, магний гидроксидінің Mg(OH)2 аморфтық тұнбасын түсірмеу үшін.
2-тәжірибе. Пробиркаға 1-2 тамшы магний тұзының (MgCl2) ерітіндісін құйып оған 2-3 тамшыдан NH4OH және NH4Cl (аммиакты буферлі ерітінді) ерітінділерін қосады. Содан кейін алынған реакциялық қоспаға 1-2 тамшы натрий гидрофосфатын қосады. Тұнбаның түсуін бақылаңдар. Реакция аяқталғаннан кейін магний-аммоний фосфатына тән кристалдық тұнба түзіледі. Хлорлы магнийдің натрий гидрофосфатымен әрекеттесу реакциясын жазыңдар.
Тәжірибені жүргізу шарттары:
1. Реакция аммиакты ортада (аммиакты буферлі ерітінді NH4OH+NH4Cl қатысында) рН=8 жүргізіледі.
2. NH4+ катионының артық мөлшері MgNH4PO4 тұнбасының түсуіне кедергі келтіреді.
3. 1-ші аналитикалық топ катиондарынан басқа, барлық басқа аналитикалық топ катиондары реакцияның жүруіне кедергі жасауы мүмкін.
Не нашли, что искали? Воспользуйтесь поиском: