
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Получение солей и их свойства
Опыт 11. Получение и свойства средних солей
а) Взаимодействие металла с кислотой:
Ход работы: В пробирку опустите гранулу цинка, добавьте 2н. раствор Н2SO4.
Отметьте эффект реакции. Составьте молекулярное и ионные уравнения реакции. Сделайте вывод о способе получения соли.
б) Взаимодействие соли с металлом:
Ход работы: В пробирку прилейте 0,1н. раствор CuSO4 затем поместите в раствор гранулу цинка. Дайте постоять 5 минут.
Отметьте эффект реакции. Составьте молекулярное и ионные уравнения реакции. Сделайте вывод о способе получения солей и их свойствах.
в) Получение солей при взаимодействии основания и кислотного оксида
Ход работы: В пробирку налейте 5 мл раствора гидроксида кальция (известковой воды) Са(ОН)2 и пропустите через раствора оксид углерода (ΙV) (углекислый газ) СО2 из аппарата Киппа.
Наблюдайте помутнение раствора в результате образования взвешенных частиц средней соли угольной кислоты СаСО3. Продолжайте пропускать газ через раствор до тех пока, пока весь осадок не растворится в результате образования растворимой соли Са(НСО3)2.
Напишите молекулярные и ионные уравнения реакций. Сделайте вывод о растворимости кислой и средней солей угольной кислоты, их получении и свойствах.
г) Получение труднорастворимой соли при взаимодействии кислоты с растворимой солью
Ход работы: В пробирку налейте 2 мл раствора хлорида бария ВаCl2 и прилейте такой же объем серной кислоты Н2SO4. При добавлении к раствору серной кислоты выпадает белый осадок труднорастворимой соли.
Наблюдайте образование осадка. Напишите уравнения реакции в молекулярной и ионной форме. Сделайте вывод о способах получения, свойствах солей.
д) Взаимодействие соли со щелочью
Ход работы:
К раствору хлорида железа (III) добавьте раствор щелочи.
Наблюдайте образование осадка. Напишите уравнения реакции в молекулярной и ионной форме. Сделайте вывод о способах получения, свойствах солей.
е) Взаимодействие труднорастворимой соли с кислотой
Ход работы: Положите в пробирку кусочек карбоната кальция (мела или мрамора) СаСО3 и прилейте 2 мл раствора хлороводородной кислоты.
Наблюдайте выделение газа. Напишите уравнения реакции в молекулярной и ионной форме. Сделайте вывод о свойствах соли.
ж) Разложение соли при нагревании
Ход работы: Гидроксокарбонат меди (ΙΙ) (CuOH)2CO3 разлагается при нагревании на три вещества: оксид углерода (ΙV), оксид меди (ΙΙ) и воду:
(CuOH)2CO3  CO2↑ + CuO + H2O.
CO2↑ + CuO + H2O.
Cоберите прибор, как указано на рисунке 1. Насыпьте в пробирку до 1/4 её объёма порошок гидроксокарбоната меди (ΙΙ). Закройте пробку с газоотводной трубкой и укрепите её в зажиме штатива так, чтобы пробирка была слегка наклонена в сторону пробки. Газоотводную трубку опустите в пустую склянку (химический стакан или коническую колбу). Нагрейте пробирку с основной солью в пламени спиртовки, начиная нагревать от горловины пробирки до дна её. Нагревайте до тех пор, пока всё содержимое пробирки не превратится в черный порошок. Наблюдайте конденсацию воды на холодных частях пробирки. Выньте газоотводную трубку из склянки и проверьте собранный в колбе газ при помощи горящей лучинки.
Сделайте вывод о свойствах основной соли.
и) Взаимодействие соли с другой солью
Ход работы: В пробирку налейте 2 мл раствора нитрата свинца Pb(NO3)2 и прилейте такое же количество раствора иодида калия KI.
Отметьте эффект реакции. Напишите уравнения реакции в молекулярной и ионной форме. Сделайте вывод о способе получения и свойствах средней соли.

Рис. 1 − Разложение малахита
Вопросы и задачи для практического занятия
№ 1
1. Из приведенного списка соединений выберите: а) оксиды; б) основания;
в) кислоты; г) соли: KMnO4; NaHS; Cu(OH)Cl; Zn(OH)2; H2CO3; CO; Mn(OH)3; Fe2O3; H2MnO4. Назовите соединения. Составьте уравнения реакций, характеризующих способы получения и свойства оксида углерода (ΙV).
2. Составьте уравнения реакций, протекающих в следующем ряду превращений:
 |

 S → CuS → SO2 ↔ H2SO3 → KHSO3 → K2SO3 → K2SO4 → BaSO4
S → CuS → SO2 ↔ H2SO3 → KHSO3 → K2SO3 → K2SO4 → BaSO4
 ________________H2SO4
________________H2SO4
№ 2
1. Из приведенного списка соединений выберите: а) оксиды; б) основания;
в) кислоты; г) соли: Cu2O; HMnO4; Zn(OH)Cl; FeCl3; Pb(OH)2; NH4OH; CO2; H2SO4; KHCO3. Назовите соединения. Составьте уравнения реакций, характеризующих способы получения и свойства NaHCO3.
2. Составьте уравнения реакций, протекающих в следующем ряду превращений:





 FeCI2 → Fe(OH)Cl → Fe(OH)2
FeCI2 → Fe(OH)Cl → Fe(OH)2
 FeO ↔ Fe →
FeO ↔ Fe →


 FeCl3 → Fe(OH)Cl2 → Fe(OH)3
FeCl3 → Fe(OH)Cl2 → Fe(OH)3
 |


 № 3
№ 3
1. Из приведенного списка соединений выберите: а) оксиды; б) основания;
в) кислоты; г) соли: H2S; Sn(OH)2; CuO; KH2PO4; AlCl3; Fe(OH)3; SO3; KOH; H2CO3. Назовите соединения. Составьте уравнения реакций, характеризующих способы получения и свойства КОH.
2. Составьте уравнения реакций, протекающих в следующем ряду превращений:






 NH4Cl ↔ NH3 → NO → NO2 → HNO2 → KNO2 ↔ KNO3 → HNO3 → Cu(NO3)2
NH4Cl ↔ NH3 → NO → NO2 → HNO2 → KNO2 ↔ KNO3 → HNO3 → Cu(NO3)2

№ 4
1. Из приведенного списка соединений выберите: а) основные оксиды;
б) гидроксиды; в) кислые соли; г) бинарные соединения: (CaOH)2CO3; PbO; KH2PO4; MnO; KOH; H2S; HClO; Ba(HCO3)2; NH3; CrO; K2H2SiO4; Fe(OH)2; CO2. Назовите соединения. Составьте уравнения реакций, характеризующих способы получения и свойства оксида алюминия (ΙΙΙ).
2. Составьте уравнения реакций, протекающих в следующем ряду превращений:
 |
CuS → CuO → Cu → CuSO4 → Cu(OH)2 → CuOHCl → CuCl2 ↔ [Cu(NH3)4]Cl2




 |
K2[Cu(OH)4] CuI
№ 5
1. Из приведенного списка соединений выберите: а) кислородные кислоты;
б) амфотерные оксиды; в) основные соли; г) щелочи: H2S; HClO2; KOH; H2SO4; (CaOH)2CO3; PbO; K2HPO4; MnO; NH3; Cr2O3; FeOHCl; CO; NH4OH. Назовите соединения. Составьте уравнения реакций, характеризующих способы получения и свойства разбавленной азотной кислоты.
2. Составьте уравнения реакций, протекающих в следующем ряду превращений:

 KCl →AgCl→ [Ag(NH3)2]Cl→ NH4NO3→NH3 → [Zn(NH3)4]Cl2
KCl →AgCl→ [Ag(NH3)2]Cl→ NH4NO3→NH3 → [Zn(NH3)4]Cl2
 KCl →Cl2→ KClO → I2 → KI3
KCl →Cl2→ KClO → I2 → KI3
 KClO3 → O2.
KClO3 → O2.
Вопросы и задачи для самостоятельной работы (РГР)
1. Составьте формулы оксидов лития, кальция, алюминия, кремния,
азота (V), серы (VI), хлора (VII), хрома (VI), железа (II), железа (III), азота (II), азота (I) и укажите к какому типу оксидов они относятся?
2. Дайте химические названия оксидов: B2O3, K2O, CrO3, CrO, P2O5, Cu2O, PbO2, NiO, CO2, Ag2O.
3. Сравните химические свойства оксидов:
а) CO и CO2 б) Na2O и MgO в) FeO и Fe2O3
Ответ подтвердите составлением соответствующих уравнений реакций.
4. Какие кислоты соответствуют следующим кислотным оксидам: SiO2, P2O5, N2O5, N2O3?
5. Приведите примеры бескислородных и кислородных кислот. Дайте химические названия следующих кислот:
HCl, H2CO3, H2CrO4, H2SO3, H2SiO3, H2S.
6. С какими из указанных веществ будет реагировать серная кислота:
Ca(OH)2, CO2, K2O, BaCl, Cu(NO3)2, H3PO4, Fe2O3?
Составьте уравнения протекающих реакций.
7. Укажите, какие из указанных оснований являются растворимыми, а какие – труднорастворимыми в воде: KOH, Ba(OH)2, Al(OH)3, Mg(OH)2, Fe(OH)2, Cr(OH)3, NH4OH, Zn(OH)2. Какие основания называются щелочами? Какие из указанных оснований к ним относятся?
8. Напишите уравнения реакций получения NаОН, Ba(OH)2, исходя:
1) из металлов натрия и бария;
2) из их оксидов.
9. Составьте уравнения реакций между соответствующими кислотами и основаниями (или амфотерными гидроксидами), приводящие к образованию следующих солей:
PbI2, KHCO3, CaHPO4, MgSO4, AlOHCl2, (MgOH)2CO3.
10. Составьте уравнения перевода нижеследующих кислых солей в средние: Mg(HCO3)2, K2HPO4, KH2PO4, NaHS.
11. Как перевести основные соли в средние соли:
CuOHCl, FeOHNO3, MgOHBr, Al(OH)2Cl? Напишите уравнения реакций.
12. Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) BaO → Ba(OН)2 → BaCl2 → Ba(NO3)2 → BaSO4 → H2[Ba(SO4)2],
б) Fe → Fe2O3 → FeCl3 → Fe(NO3)3 → Fe(OH)3 → Fe2O3 → NaFeO2,
в) Cu ← CuO → CuSO4 → Cu(OH)2 → CuО → K2CuO2 → CuСl2,
г) K → KOH → KHS → K2S → FeS → SO2 → KHSO3,

 д) CaO → CaCl2
д) CaO → CaCl2


 Ca
Ca
Ca(OH)2 → Ca(NO3)2.
13. Напишите полные и краткие ионные уравнения следующих реакций:
а) Ca(NO3)2 + K2CO3 → CaCO3 + 2KNO3,
б) 2HNO3 + Ba(OH)2 → Ba(NO3)2 + 2H2O,
в) Ba(NO3)2 + K2SO4 → BaSO4 + 2KNO3,
г) K2CO3 + 2HCl → 2KCl + H2O + CO2,
д) Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2,
е) 2NaOH + Fe(NO3)2 → Fe(OH)2 + 2NaNO3,
ж) Pb(NO3)2 + K2SO4 → PbSO4 + 2KNO3,
з) Na2SiO3 + Ba(OH)2 → BaSiO3 + 2NaOH,
и) FeCl3 + 3CsOH → Fe(OH)3 + 3CsCl,
к) 3FeSO4 + 2Na3PO4 → Fe3(PO4)2 + 3Na2SO4.
14. Составьте молекулярные и ионные уравнения реакций между веществами:
| a) KOH и MgCl2, | е) Pb(OH)2 и HNO3, |
| б) NaOH и H2SO3, | ж) Na2SO4 и BaCl2, |
| в) K2S и HCl, | и) Na2CO3 и HCl, |
| г) CH3COOК и H2SO4, | к) H2SiO3 и KOH, |
| д) KHCO3 и H2SO4, | л) Fe(OH)Cl и HNO3. |
15. Составьте молекулярные уравнения реакций по кратким ионным уравнениям:
а)  ; ;
| е)  ; ;
|
б)   ; ;
| ж)  ; ;
|
в)   ; ;
| и)  ; ;
|
г)   ; ;
| к)  ; ;
|
д)  ; ;
| л) 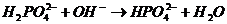 . .
|
16. Закончите уравнения реакций: Напишите в молекулярной и ионной форме уравнения реакций:
| 1) CO2 + NaOH → __________________, | 6) CaCl2 + Na2CO3 → _______________, |
| 2) P2O5 + NaOH → _________________, | 7) Pb(NO3)2 + 2KI → ________________, |
| 3) HNO2 + O2 → ___________________, | 8) BaCl2 + Na2CrO4 → _______________, |
| 4) MnCl2 + Na2S → _________________, | 9) KH2PO4 + HCl → ________________, |
| 5) H3PO4 + 3NaOH → _______________, | 10) Fe(OH)Cl2 + KOH → ____________. |
17. Определите тип солей и дайте им названия:
Na3PO4; FeCl2; Na2HPO4; FeOHCl; NaH2PO4; Fe(OH)2NO3; Na2CO3; (CuOH)2CO3; NaHCO3; NiSO4; PbI2; NaHS; Cr2S3; K4[Fe(CN)6]; [Al(OH2)6]Cl3.
18. Напишите формулы солей: сульфат калия; гидросульфат натрия; метасиликат натрия; гидроксохлорид цинка; гидроксокарбонат магния; сульфат алюминия; гидроксосульфат алюминия; сульфат аммония железа (ΙΙΙ).
19. Составьте уравнения реакций, протекающих в следующей цепи превращений:
 K[Fe(OH)4]
K[Fe(OH)4]
↑
Fe → FeCl3 → Fe(OH)Cl2 → Fe(OH)3 → Fe2O3 → Fe2(SO4)3 → FeSO4 → Fe.
20. Амфотерность указанных ниже гидроксидов проявляется в том, что они:
| 1) гидроксида бериллия | а) взаимодействуют с растворами щелочей |
| 2) гидроксида цинка | б) при прокаливании превращаются в амфотерные оксиды |
| 3) гидроксида алюминия | в) взаимодействуют с растворами кислот и щелочей |
| 4) гидроксида олова (ΙΙ) | г) взаимодействуют с растворами кислот |
| 5) гидроксида свинца (ΙΙ) | д) растворяются в воде |
| 6) гидроксида хрома (ΙΙΙ) | е) проявляют кислотные свойства |
| 7) гидроксида меди (ΙΙ) | |
| 8) гидроксида железа (ΙΙΙ) | |
| 9) гидроксида титана (ΙV) | |
| 10) гидроксида марганца (ΙV) |
21. Напишите уравнения диссоциации электролитов:
| 1) H3BO3; Be(OH)2; Cu(OH)Cl, | 6) H2CO3; Al(OH)3; KHCO3, |
| 2) H3PO4; KH2PO4; Ca(OH)2, | 7) H4SiO4; Na2HPO4; Ni(OH)2, |
| 3) Ba(OH)2; H2S; MgOHCl, | 8) KHS; NaHSO3; H2SO4, |
| 4) Mn(OH)2; H2CO3; KHCO3, | 9) CuCl2; CuOHCl; Fe(OH)3, |
| 5) KH2PO4; H2S; Fe(OH)3, | 10) Al(OH)2Cl; K2HPO4; H3BO3. |
22. Вычислите эквивалент кислот и оснований в следующих уравнениях реакций:
1) H2SO4 + KOH → KHSO4 + H2O,
2) H2SO4 + Ca(OH)2 → CaSO4 + 2H2O,
3) Al(OH)3 + HCl → Al(OH)2Cl + H2O,
4) Al(OH)3 + H2SO4 → Al(OH)SO4 + 2H2O,
5) Al(OH)3 + H3PO4 → AlPO4 + 3H2O,
6) H3PO4 + Ba(OH)2 → BaHPO4 + 2H2O,
7) H3PO4 + KOH → KH2PO4 + H2O,
8) Mg(OH)2 + HNO3 → Mg(OH)NO3 + H2O,
9) Mg(OH)2 + H2CO3 → MgCO3 + 2H2O,
10) Fe(OH)3 + 2HNO3 → Fe(OH)(NO3)2 + 2H2O.
 2.8 Входной тестовый контроль
2.8 Входной тестовый контроль
Вариант № 1
Дополните:
1. Оксидами называются _______________________________________________
2. Кислые соли состоят _________________________________________________
3. Щелочи можно получить _____________________________________________
Выберите правильный ответ:
4. Ряд, в котором представлены только соли ______________________________
1) KMnO4; H2SO4; K[Al(OH)4],
2) KClO4; Mn(NO3)2; Pb(OH)2,
3) Na3PO4; K2[Zn(OH)4]; MnCl2,
4) Ca(OH)2; KMnO4; NaClO.
5. Число кислот среди перечисленных веществ: H2[PtCl6]; KH2PO4; HClO; Na4SiO4; H2CO3; H3AsO4; NaH; HCl равно:
1) 2; 2) 3; 3) 4; 4) 5.
6. К кислотным оксидам относятся 1) CO2; PbO; 3) Mn2O7; SO2;
2) SO3; CrO3; 4) CaO; MnO.
7. Оксид алюминия относится к _____________________________________
1) основным оксидам; 3) амфотерным оксидам;
2) кислотным оксидам; 4) безразличным оксидам.
8. Установите соответствие между названием вещества и его принадлежностью
к определенному классу неорганических соединений:
| Название | Класс |
| А) сероводород | 1) простое вещество |
| Б) гашеная известь | 2) бинарное соединение |
| В) питьевая сода | 3) оксид |
| Г) медный купорос | 4) гидроксид |
| 5) соль | |
| 6) основание |
9. Слабыми кислотами являются _________________________________________
1) HClO; 2) HMnO4; 3) CH3COOH;
4) HClO4; 5) H2CO3; 6) H2SO4.
10. Для осуществлений цепочки превращений
Ca → CaO → Ca(OH)2 → CaCl2 → Ca3(PO4)2 → P → P2O3 необходимо последовательно использовать следующие вещества:
1) H2O; K3PO4; SiO2 и C; O2; HCl.
Составьте уравнения протекающих реакций.
Вариант № 2
Дополните:
1. Гидроксиды – это ___________________________________________________
2. Основные соли состоят _______________________________________________
3. Основания можно получить ___________________________________________
Выберите правильный ответ:
4. Ряд, в котором представлены только основания _________________________
1) Ca(OH)2; Pb(OH)2; H2SO4;
2) KMnO4; HClO4; PbCl2;
3) HClO4; Al(OH)3; KNO3;
4) Mn(OH)2; Ba(OH)2; Fe(OH)2.
5. Число гидроксидов среди перечисленных веществ: HClO; Mn(OH)2; (CuOH)2CO3; KH; Al(OH)3; H2[Ba(SO4)2]; PbCO3; Ba(OH)2; HCl равно:
1) 3; 2) 5; 3) 7; 4) 9.
6. К амфотерным гидроксидам относятся:
1) Al(OH)3; Ba(OH)2; 3) Zn(OH)2; KOH;
2) Pb(OH)2; Cu(OH)2; 4) Be(OH)2; Cr(OH)3.
7. Гидроксид бария проявляет только _________________________________
1) основные свойства; 3) амфотерные свойства;
2) кислотные свойства; 4) не проявляет кислотно-основных свойств.
8. Установите соответствие между формулой вещества и его принадлежностью
к определенному классу неорганических соединений:
| Название | Класс |
| А) KHCO3 | 1) бинарное соединение |
| Б) CrO3 | 2) кислота |
| В) Ba(OH)2 | 3) кислая соль |
| Г) HClO3 | 4) оксид |
| 5) щелочь | |
| 6) амфотерный гидроксид |
9. Термически неустойчивы и разлагаются при нагревании __________________
1) K2CO3; 2) KNO3; 3) K[Al(OH)4];
4) Cu(OH)2; 5) HCl; 6) Cr(OH)3.
10. В схеме превращений
K  X1
X1  X2
X2  X3
X3  X4
X4  Х5 являются _____________
Х5 являются _____________
1) вода; 2) оксид кальция; 3) щелочь; 4) оксид углерода (ΙV);
5) кислая соль; 6) карбонат кальция.
Составьте уравнения протекающих реакций.
Вариант № 3
Дополните:
1. Основными оксидами называются ____________________________________
2. Двойные соли состоят ________________________________________________
3. Кислородные кислоты можно получить _________________________________
Выберите правильный ответ:
4. Ряд, в котором представлены только гидроксиды _______________________
1) НClO4; Al(OH)3; Вa(OH)2;
2) H2SO4; K[Al(OH)4]; MnCl2;
3) H2CO3; BaCO3; Al(OH)3;
4) НClO3; Fe(OH)3; PbSO4.
5. Число солей среди перечисленных веществ: HClO; K[Al(OH)4]; MnO2; Na2SO4; KH2PO4; Pb(OH)2; (CuOH)2CO3; Ca(OCl)Cl; BaO равно:
1) 3; 2) 5; 3) 7; 4) 9.
6. К основным оксидам относятся 1) CaO; MgO; 3) SnO; SO2;
2) MnO; PbO; 4) BaO; MnO.
7. Гидроксид бериллия проявляет только ______________________________
1) основные свойства; 3) амфотерные свойства;
2) кислотные свойства; 4) свойства сильных электролитов.
8. Установите соответствие между названием вещества и его принадлежностью
к определенному классу неорганических соединений:
| Название | Класс |
| А) оксид азота (ΙΙΙ) | 1) основной оксид |
| Б) гидроксид аммония | 2) кислотный оксид |
| В) хлорид бария | 3) основная соль |
| Г) сероводород | 4) средняя соль |
| 5) щелочь | |
| 6) бинарное соединение |
9. Продуктами реакции, протекающей между ортофосфорной кислотой и гидроксидом калия являются ____________________________________________
1) K3PO4; 2) H2O; 3) KH2PO4; 4) K2HPO4;
5) H2; 6) O2; 7) P2O5; 8) KCl.
10. В схеме превращений РН3 → Х → КРО3 → Н3РО4 → Са(РО4)2 → Р
пропущеновещество Х, которое называется _______________________________
1) оксид фосфора (ΙΙΙ); 2) оксид фосфора (V);
3) фосфор; 4) фосфид водорода.
Составьте уравнения протекающих реакций.
Вариант № 4
Дополните:
1. Основаниями называются ___________________________________________
2. Смешанные соли состоят ____________________________________________
3. Амфотерные гидроксиды можно получить ______________________________
Выберите правильный ответ:
4. Ряд, в котором представлены только кислые соли _______________________
1) KHCO3; CaSO4; K[Al(OH)4];
2) NaH2PO4; KHS; Mn(HCO3)2;
3) KHS; НClO4; Ca(OH)2;
4) KНCO3; K2[Zn(OH)4]; MnCl2.
5. Число щелочей среди перечисленных веществ: K2O2; NH4OH; Mg(OH)2; KClO; Ba(OH)2; Mn(OH)2; NaOH; CaCO3 равно:
1) 3; 2) 4; 3) 5; 4) 8.
6. К амфотерным оксидам относятся _________________________________
1) MgO; ВaO; 2) SO3; СO2;
3) Al2O3; ВеO; 4) PbO; ZnO.
7. Оксид серы (VΙ) проявляет только _________________________________
1) основные свойства; 3) амфотерные свойства;
2) кислотные свойства; 4) свойства безразличного оксида.
8. Установите соответствие между формулой вещества и его принадлежностью
к определенному классу неорганических соединений:
| Название | Класс |
| А) K[Al(OH)4] | 1) двойная соль |
| Б) MgNH4PO4 | 2) основная соль |
| В) (CuOH)2CO3 | 3) средняя соль |
| Г) KH2PO4 | 4) кислая соль |
| 5) комплексная соль | |
| 6) смешанная соль |
9. Хлорид железа (ΙΙΙ) получают реакцией _________________________________
1) Fe + Cl2 2) Fe + HCl 3) Fe2O3 + H2O
4) FeO + HCl 5) Fe2O3 + KOH 6) Fe2O3 + HCl
10. Конечным веществом в цепочке превращений на основе азота:
HNO3 (конц.)  Х1
Х1  Х2
Х2  Х3
Х3  является _____________
является _____________
1) нитрит калия; 2) оксид азота (Ι);
3) оксид азота (ΙV); 4) гидроксид аммония.
Составьте уравнения протекающих реакций.
Не нашли, что искали? Воспользуйтесь поиском: