
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ТЕМЫ РЕФЕРАТИВНЫХ РАБОТ
1. Соли, их использование в агропромышленном комплексе.
2. Соли, их применение в пищевой промышленности.
3. Электролиз растворов и расплавов различных типов солей, применение в промышленности.
4. Гидролиз различных типов солей, применение в народном хозяйстве.
5. Минеральные (неорганические) кислоты, их получение и применение в народном хозяйстве.
6. Соли в природе, разработка и использование.
7. Простые и комплексные минеральные удобрения, их получение, особенности применения.
8. Соли в природных водах: классификация водных источников по содержанию солей, их использование.
9. Бинарные соединения в природе, их переработка и использование в народном хозяйстве.
10. Газообразные оксиды в окружающей среде. Их влияние на живые организмы.
11. Использование (применение) солей для охраны окружающей среды.
12. Использование щелочей в народном хозяйстве.
13. Применение солей в медицине и ветеринарии.
14. Соли как катализаторы в органическом синтезе.
15. Катализ с участием простых веществ.
16. Катализ с участием оксидов металлов.
17. Комплексные соли – новый тип микроудобрений, их использование в агропромышленном комплексе.
18. Получение простых веществ.
19. Получение и свойства оксидов азота.
20. Соединения азота в природе; их синтез и превращения в природных условиях.
21. Получение бинарных водородных соединений; их свойства и применение.
22. Получение кислородсодержащих (кислородных) кислот, их использование в народном хозяйстве.
23. Оксиды в природе, их применение в народном хозяйстве.
24. Вода в природе, её виды; использование в народном хозяйстве.
25. Соли в природе Удмуртии, их разработка и использование в народном хозяйстве.
26. Комплексные соединения – применение в народном хозяйстве.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Основная литература:
1. Князев, Д.А. Неорганическая химия /Д.А. Князев, С.Н. Смарыгин. − М.: Дрофа, 2005. − 592 с.
2. Хомченко, Г.П. Неорганическая химия /Г.П. Хомченко, И.К. Цитович. – СПб.: Квадро; КОСТА, 2010. − 464 с.
Дополнительная литература:
1. Ахметов, Н.С. Общая и неорганическая химия /Н.С. Ахметов. − М.: Высшая школа, 2001. − 743 с.
2. Карапетьянц, М.Х. Общая и неорганическая химия /М.Х. Карапетьянц, С.И. Дракин. − М.: Химия, 2000. − 592 с.
3. Кнунянц, И. Химический энциклопедический словарь /И. Кнунянц. – М.: Советская энциклопедия, 1983. – 792 с.
4. Угай, Я.А. Неорганическая химия /Я.А. Угай. −М.: Высшая школа, 2004. −527 с.
5. Хомченко, Г.П. Пособие по химии для поступающих в вузы /Г.П. Хомченко, И.Г. Хомченко. − М.: Новая Волна, 2008. − 480 с.
6. Хомченко, Г.П. Сборник задач по химии для поступающих в вузы /Г.П. Хомченко, И.Г. Хомченко. − М.: Новая волна, 2009. − 288 с.
ПРИЛОЖЕНИЯ
Приложение А

Приложение Б
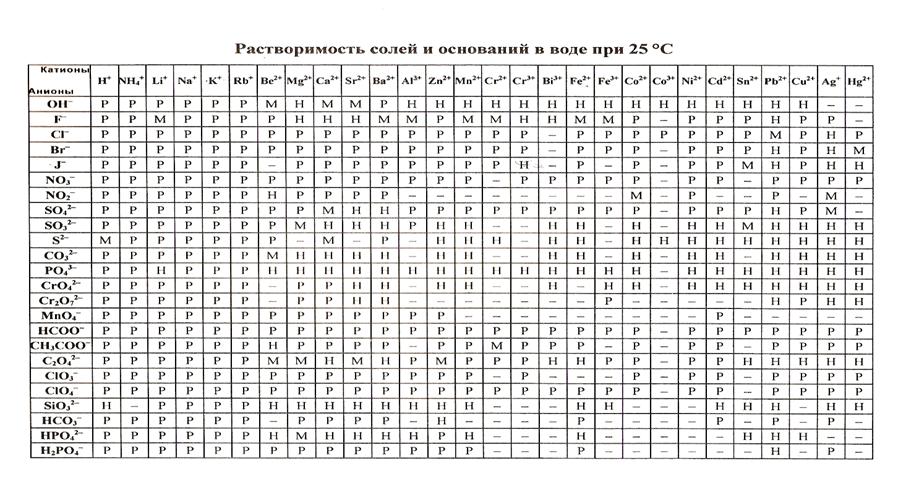
Приложение В
Таблица В.1 – Ряд стандартных электродных потенциалов (ряд активности металлов)
| Li | Rh | K | Ba | Sr | Ca | Na | Mg | Al | Mn | Zn | Cr | Fe | Cd | Co |
| −3,04 | −2,93 | −2,92 | −2,90 | −2,89 | −2,87 | −2,71 | −2,36 | −1,66 | −1,18 | −0,76 | −0,74 | −0,44 | −0,40 | −0,28 |
| Ni | Sn | Pb | H2 | Sb | Bi | Cu+/Cu | Cu2+/Cu | Hg  /Hg /Hg
| Hg  /Hg /Hg
| Ag | Pd2+/Pd | Pt2+/Pt | Au3+/Au | Au+/Au |
| −0,25 | −0,11 | −0,13 | 0,00 | +0,21 | +0,28 | +0,52 | +0,31 | +0,79 | +0,85 | +0,80 | +0,99 | +1,19 | +1,50 | +1,69 |
Приложение Г
Таблица Г.1 – Меры первой помощи при возможных несчастных случаях при выполнении лабораторной работы
| Возможные несчастные случаи | Первая помощь |
| Порезы стеклом | удалить осколки стекла, вытереть рану чистой марлей или ватой, присыпать порошком белого стрептоцида и завязать |
| Ранения с сильным кровотечением | остановить кровь перевязкой выше места ранения (толстостенной каучуковой трубкой или резиновым ремнем), забинтовать пострадавшего и отправить в медицинский пункт |
| Ожог раскаленными предметами | смазать обожженное место насыщенным раствором КМnO4 или 5%-ным линиментом синтомицина |
| Ожог водяным паром или кипящей водой | помощь та же, что и при ожоге раскаленными предметами |
| Ожоги концентрированными кислотами | тщательно смыть кислоту водой, после чего смазать обожженное место раствором (5 - 10%) гидрокарбоната натрия NaHCO3 или присыпать порошком этой соли (можно применить порошок CaCO3) |
| Ожег плавиковой (фтористоводородной) кислотой | погрузить обожженное место на 10-15 мин в 3%-ный раствор NH4OH или же промыть обильным количеством воды и наложить компресс с пастой, приготовленной из суспензии MgO |
| Ожег глаз концентрированными кислотами | тщательно промыть глаза 20%-ным раствором NaHCO3 или буры |
| Ожег глаз крепкими щелочами | после тщательного промывания глаз водой промыть их раствором слабой кислоты (2%-ным раствором борной или уксусной кислоты) |
| Ожег жидким бромом | промыть пораженное место водой и слабым раствором аммиака; поставить компресс из 1%-ного раствора карболовой кислоты |
| Отравление лабораторными газами (светильным газом, окислами азота, бромом, аммиаком и др.) | немедленно вывести отравленного на чистый воздух; если нужно сделать искусственное дыхание и дать кислород; при отравлении бромом и хлором, а также йодом, осторожно вдыхать пары аммиака из 10%-ного раствора NH4OH; хорошо проветрить помещение |
| Отравление кислотами (HCl, H2SO4, CH3COOH) | принимать внутрь суспензию магнезии, молоко, муку с водой |
| Отравление щелочами | принимать внутрь 5%-ную уксусную кислоту, лимонную кислоту или сок лимона |
Приложение Д
Таблица Д.1 – Термины и определения в химии
| Термин | Определение |
| Аллотропия | Способность атомов одного и того же элемента к образованию нескольких простых веществ |
| Атом | Электронейтральная частица, состоящая из положительно заряженного атомного ядра и отрицательно заряженных электронов |
| Гидроксиды | Сложные вещества – продукты взаимодействия оксидов с водой (это условное определение, т.к. большинство основных оксидов с водой не взаимодействуют) |
| Бинарные соединения | Сложные вещества, молекулы которых состоят из атомов двух элементов, кроме оксидов |
| Ионные реакции | Реакции, протекающие между ионами |
| Кислоты | Сложные вещества, состоящие из водорода и кислотного остатка. Электролиты, дающие при диссоциации в качестве катионов только катионы водорода 
|
| Металлические вещества | Простые вещества, которые в химических реакциях проявляют свойства восстановителей (или восстановительные свойства), отдавая электроны |
| Моль вещества | Количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 г (0,012 кг) изотопа углерода 12С |
| Молярная масса | Величина, равная отношению массы вещества к количеству вещества |
| Неметаллические вещества | Простые вещества, которые в химических реакциях проявляют свойства, как окислителя, так и восстановителя, т.е. они способны как принимать, так и отдавать электроны |
| Необратимые химические реакции | Химические реакции, которые протекают в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества (образующиеся продукты уходят из сферы реакции – выпадают в виде осадка, выделяются в виде газа, образуются малодиссоцированное соединение или реакция сопровождается большим выделением энергии) |
| Обратимые химические реакции | Химические реакции, которые одновременно протекают в двух взаимно противоположных направлениях |
| Оксиды | Сложные вещества, молекулы которых состоят из атомов двух элементов, один из которых кислород в степени окисления (– 2) |
| Продолжение таблицы Д. | |
| Основания | Соединения, в которых положительно заряженный ион металла связан с отрицательно заряженным одним или несколькими гидроксид – ионами. Электролиты при диссоциации которых в качестве анионов образуют только гидроксид – ионы |
| Относительная атомная масса элемента, Аr | Величина равная отношению массы атома данного элемента к 1/12 массы изотопа углерода 12С |
| Относительная молекулярная масса вещества, Мr | Величина равная отношению массы молекулы данного вещества к 1/12 массы изотопа углерода 12С |
| Простые вещества | Вещества, молекулы которых состоят из атомов одного элемента |
| Реакции замещения | Реакции между простыми и сложными веществами, в результате которых атомы простого вещества замещают атомы сложного вещества |
| Реакция нейтрализации | Реакция между кислотой и основанием |
| Реакции обмена | Реакции, в результате которых два вещества обмениваются своими ионами, образуя два новых вещества |
| Реакции разложения | Реакции, в результате которых из одного вещества образуется несколько новых |
| Реакции соединения | Реакции, в результате которых из двух или нескольких веществ образуется одно новое вещество |
| Сложные вещества | Вещества, молекулы которых состоят из атомов двух или более элементов |
| Соли | Продукты полного или частичного замещения водорода в кислотах на ион металла; или полного или частичного замещения гидроксид – ионов в основаниях или амфотерных гидроксидах на кислотные остатки |
| Соли средние (или нормальные) | Продукты полного замещения атомов водорода в молекуле кислоты на ионы металла, или продукты полного замещения гидроксильных групп в молекуле основания (амфотерного гидроксида) на кислотные остатки |
| Соли кислые | Продукты неполного замещения атомов водорода в молекулах многоосновных кислот на ионы металла |
| Соли основные | Продукты неполного замещения гидроксогрупп в молекулах многокислотных оснований (или амфотерных гидроксидов) на кислотные остатки |
| Соли двойные | Состоят из ионов двух различных металлов и кислотных остатков одной и той же кислоты |
| Соли смешанные | Состоят из катионов одного металла и кислотных остатков двух различных кислот и могут быть образованы при взаимодействии солей двух различных кислот одного и того же металла |
| Комплексные соли | Состоят из сложного комплексного иона – внутренней сферы, которая заключена в квадратные скобки, и внешней сферы |
| Степень окисления | Условный заряд, который приписывается атому, исходя их предположения, что молекула соединения состоит только из ионов, и при этом электронейтральна. |
| Продолжение таблицы Д. | |
| Химические реакции |  Химические взаимодействия веществ Химические взаимодействия веществ
|
| Химические уравнения | Изображение реакций при помощи химических формул и математических знаков |
| Химический элемент | Вид атомов, характеризующихся определенной совокупностью свойств |
| Щелочи | Растворимые в воде основания |
| Эквивалент | Реальная или условная частица вещества, которая в данной реакции эквивалентна атому или иону водорода, т.е. соединяется с одним атомом или ионом водорода либо замещает его |
| Эквивалентная масса (молярная масса эквивалента вещества) | Масса одного эквивалента данного вещества |
| Экзотермические химические реакции (∆Н < 0) | Химические реакции, происходящие с выделением теплоты (энергии), теплосодержание системы уменьшается |
| Эндотермические химические реакции (∆Н > 0) | Химические реакции, происходящие с поглощением теплоты (энергии), теплосодержание системы возрастает |
Учебное издание
Основные понятия химии.
Не нашли, что искали? Воспользуйтесь поиском: