
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Классификация белков. В основу классификации белков положены разные признаки
В основу классификации белков положены разные признаки. Так, простые белки отличаются от сложных разными продуктами гидролиза.
Простые белки (протеины) гидролизуются до аминокислот.
К ним относятся запасные, скелетные и ферментные белки.
По растворимости в отдельных растворителях выделяют главные:
ü альбумины – белки с относительно небольшой молекулярной массой, хорошо растворимы в воде и в слабых солевых растворах; нейтральны; трудно осаждаются солями. Содержаться в курином белке, молоке;
ü глобулины – нерастворимы в воде, но растворяются в растворах солей; имеют слабо кислую реакцию. Содержаться в сыворотке крови, мышечной ткани, молоке, курином яйце. Молекулярная масса от 69000 до 300000 у.е. В растительном мире глобулины составляют большую часть белка многих семян, особенно бобовых
и масленичных культур;
ü глютелины – растворяются только в растворах щелочей. Содержаться в рисе, в клейковинных белках пшеницы.
ü проламины – белки, не растворимые в воде, растворимы в 80% спирте, содержаться в зернах злаках: пшеницы, ржи, ячменя, кукурузы, овса.
Сложные белки (протеиды) гидролизуются до аминокислот
и веществ небелкового происхождения. Отметим только следующие:
ü фосфопротеиды – белки, гидролизующиеся до аминокислот
и фосфорной кислоты; это казеин молока и вителлин желтка куриного яйца;
ü нуклеопротеиды – белки, гдролизующиеся до аминокислот
и нуклеиновых кислот (ДНК, РНК);
ü липопротеиды – белки, гидролизующиеся до аминокислот, жиров, лецитинов и других фосфатидов. Принимают участие
в формировании клейковинных белков.
Белковую часть сложных белков называют апобелком, небелковую - простетической группой.
Синтез белков
В состав природных белков входят 23  -аминокислоты. Возникает вопрос: каким образом небольшое количество кислот дает такое разнообразие белков? Ответ находится в порядке построения аминокислот в молекуле белка, их последовательности в природном полимере. Человеку удалось синтезировать несколько белков, ничем не отличающихся
-аминокислоты. Возникает вопрос: каким образом небольшое количество кислот дает такое разнообразие белков? Ответ находится в порядке построения аминокислот в молекуле белка, их последовательности в природном полимере. Человеку удалось синтезировать несколько белков, ничем не отличающихся
от аналогичных природных.
Для того, чтобы добиться результатов без участия ферментов, человек был вынужден проводить синтез по этапам, принимая определенные приемы: защищать в аминокислотах то одну, то другую реакционную группировку. Так, синтез простейшего дипептида (Гли-Ала) из глицина и аланина осуществляют по этапам по схеме:
1 Карбоксил глицина защищают этерификацией спиртом:

2 Аминогруппу аланина защищают ацетилированием:

3 Соединяют (конденсация) производные аминокислот в дипептид:
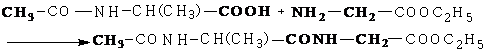
4 Снимают защитные группы гидролизом.
На основе трех аминокислот можно получить трипептид, четырех-, тетрапептид и т.д. Более совершенный способ синтеза полипептидов был предложен в 1960 году американским ученым Мерифильдом. Этот процесс идет с участием смолы в качестве твердофазного компонента, сорбирующего защитные аминокислоты одну за другой, тем самым процесс как бы автоматизируется. Таким способом в 1968 году была синтезирована рибонуклеаза в результате проведения 369 последовательных реакций.
Структура белков
Свойства макромолекул белка в значительной степени зависят
от структуры, молекулярной массы, от аминокислотного состава
и пространственной ориентации.
Главная особенность белка, которая имеет решающее значение
для их функционирования – способность самопроизвольно формировать пространственную структуру, свойственную только данному белку (так называемая самоорганизация структуры). Эта структура может быть компактной (глобулярные белки) или вытянутой (фибриллярные белки).
В глобулярных белках пространственно сближенные функциональные группы аминокислотных остатков образуют ансамбли, обладающие высокой реакционной способностью (каталитические центры ферментов) или способностью к образованию комплексов с другими молекулами. К глобулярным относятся большинство белков.
Фибриллярные белки (коллаген, кератины) – обычно выполняют
в организме структурообразующую функцию. От способа укладки полипептидных цепей в этих белках зависит их прочность, растяжимость
и другие функциональные свойства.
В белках выделяют 4 уровня организации: первичная, вторичная, третичная, четвертичная.
Первичная структура – это уникальная последовательность расположения аминокислотных остатков в молекуле белка.
Вторичная структура – это  -спираль, образованная скручиванием полипептидной цепи и поддерживаемая в пространстве с помощью водородных связей.
-спираль, образованная скручиванием полипептидной цепи и поддерживаемая в пространстве с помощью водородных связей.
Третичная структура – “упакованная”  -спираль в глобулу. Кроме водородных связей в данной структуре значение имеют еще и ионное и гидрофобное взаимодействия.
-спираль в глобулу. Кроме водородных связей в данной структуре значение имеют еще и ионное и гидрофобное взаимодействия.
Четвертичная структура – это образование из нескольких глобул единой “субъединицы” (это наиболее уязвимая структура, которая подвергается разрушению при любом вмешательстве в молекулу белка).
Не нашли, что искали? Воспользуйтесь поиском: